新闻资讯
NEWS
行业资讯
NEWS
 Crisaborole API & Intermedia…
Crisaborole API & Intermedia…  Topiroxostat API & Intermedi…
Topiroxostat API & Intermedi…  Tavaborole API & Intermedia…
Tavaborole API & Intermedia…  Upadacitinib API & Intermed…
Upadacitinib API & Intermed…  BrexpiprazoleAPI & Intermedi…
BrexpiprazoleAPI & Intermedi…  TEST
TEST  Others
Others  Ticagrelor Intermediates
Ticagrelor Intermediates  Others
Others  Parecoxib sodium Intermediat…
Parecoxib sodium Intermediat…  Canagliflozin Intermediates
Canagliflozin Intermediates  Empagliflozin Intermediates
Empagliflozin Intermediates  Dapagliflozin Intermediates
Dapagliflozin Intermediates  Tofacitinib Intermediates
Tofacitinib Intermediates  Baricitinib Intermediates
Baricitinib Intermediates  Baricitinib Intermediates
Baricitinib Intermediates  Vonoprazan Fumarate Intermed…
Vonoprazan Fumarate Intermed…  Febuxostat Intermediates
Febuxostat Intermediates  Ceftaroline fosamil Interme…
Ceftaroline fosamil Interme…  Rivaroxaban Intermediates
Rivaroxaban Intermediates  Avatrombopag Intermediates
Avatrombopag Intermediates  Ramelteon Intermediates
Ramelteon Intermediates  Pimavanserin Intermediates
Pimavanserin Intermediates  Intermediates of Carbapenems…
Intermediates of Carbapenems…  Dabigatran etexilate Interme…
Dabigatran etexilate Interme…  Crisaborole Intermediates
Crisaborole Intermediates  Finafloxacin Hydrochloride I…
Finafloxacin Hydrochloride I…  Meropenem
Meropenem  Sacubitril
Sacubitril  Apixaban Intermediates
Apixaban Intermediates  Zolpidem tartrater Intermedi…
Zolpidem tartrater Intermedi…  Tolvaptan Intermediates
Tolvaptan Intermediates  Edoxaban Intermediates
Edoxaban Intermediates  Nucleus and intermediates of…
Nucleus and intermediates of…  Acotiamide intermediates
Acotiamide intermediates  Apremilast intermediates
Apremilast intermediates  Roxadustat intermediates
Roxadustat intermediates  Linagliptin intermediates
Linagliptin intermediates  Ibrutinib Intermediates
Ibrutinib Intermediates  Eltrombopag Intermediates
Eltrombopag Intermediates  Posaconazole Intermediates
Posaconazole Intermediates 
在美国食品药品监督管理局(FDA)和产品质量研究所(PQRI)的赞助下,提高产品质量会议的目的是将监管机构,行业专业人士和学术研究人员聚集在一起,共同为增强全球药品质量创造协同增长的道路。2015FDA / PQRI会议由全体会议和20个分组会议组成,分为四个主要方面:
●新兴的监管举措;
●监管报送,评估和检查;
●产品和工艺开发;
●制造,风险管理和质量保证;
●本文提供了会议上所提出的全体会议的摘要。

药物质量的进展与挑战
美国食品和药物管理局(FDA)对药品进行管理,以确保在美国不间断地提供高质量,安全和有效的药品。FDA的愿景是推动一个最高效,快捷和灵活的制药部门,在没有广泛的监管的情况下可靠地生产高质量的药品。在过去的十年里,我们看到了这个愿景的重大进展。但与此同时,我们遇到了新的日趋复杂的挑战,其中包括不可接受的药品短缺,召回以及对供应质量和可靠性的威胁。
监管的进展与挑战
自2014年FDA /PQRI产品质量演变大会以来,FDA在提高产品质量方面取得了重大进展:
●在简化新药申请(ANDAs),生物学许可证申请(BLAs)和新药申请(NDAs)的质量评估中正式记录质量风险管理;
●开发和实施包含审查,检查,政策,研究和监督的基于团队的综合质量评估;
●出版指导草案(如质量指标,既定条件,溶出度,基于BCS的生物药和植物药开发);
●批准第一种使用连续制造工艺制造的药品,第一种使用3D打印的药品和第一种生物仿制药;
●简化基于问题的审查,为NDA和ANDA申请的质量设计原则奠定基础。
当然,最重要的进展是在FDA药品审评中心组建了药物质量办公室(OPQ)。OPQ是FDA确保向美国公众提供高质量药物的一个里程碑。OPQ旨在简化监管程序,提高监管标准,调整专业领域,开创药物质量监测的先河。支持这些目标是产品质量知识管理和信息学的创新和系统化方法。协调一致的战略将使创新者和仿制药以及国内和国际设施的监督平等。OPQ促进和鼓励新兴制药技术的开发和采用,以提高制药质量,重振美国制药行业。这在国外也适用于美国药品市场生产的药品和API。OPQ秉承“一个品质之声”的口号,体现了在全球范围内加强药品质量的审查,检查,监督,政策和研究的紧密结合。
行业的进展与挑战
产品质量的两个关键维度是供应链质量和可靠性。缺乏药物安全性和供应连续性通常归因于质量问题。解决这些质量问题的方案可以是一般的或产品特定的。一般的解决方案着重于改进质量风险管理,药品质量体系和业务流程。针对产品的解决方案专注于流程,模式和平台,以及运营和技术/分析考虑。
质量不是孤立的“口袋”,而是建立在端到端,不断挑战(如图1所示)。质量由四个阶段组成:计划,来源,制造和交付。
“计划”阶段包括平衡总需求和供应的过程,以制定最能满足采购,生产和交付要求的行动方案。这个阶段对于满足目标患者群体的需求至关重要。尽管质量的综合性质,制药行业可能需要按行业细分来设计解决方案。例如,“一刀切”模式可能会增加某些行业细分供应中断的风险。流程需要合作预测需求,并转向基于真实需求而不是预测的包含补货的模型。不幸的是,与其他制造业相比,制药行业在整个计划阶段的综合需求普遍较差。
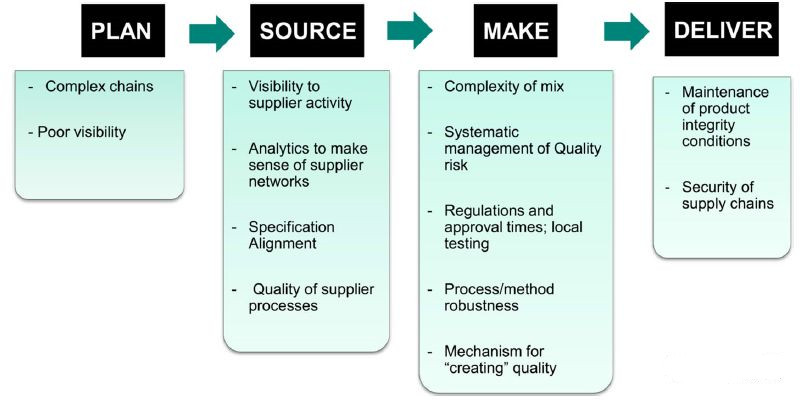
图1. 质量的四个阶段
“来源”阶段包括采购商品和服务的过程以满足计划或实际需求。以美国为中心,纵向一体化的生命科学行业的时代已经基本结束了。在过去的十年里,采购和制造业已经转移到海外以努力降低成本。然而,随着这些变化,药品制造商对其供应链的管理和控制的需求不断增加,而这些供应链现在更长,更复杂。制药工业常常不能将供应商(即原始制造商,运输商,分销商,合同制造商和供应商)的关键方面纳入其内部的性能网络中。该行业在质量和可靠性方面对供应商的认识不足,这往往导致产品召回和药品短缺。通常的做法是定期对供应商进行审计,这是不够的。这迫切需要制定指标来评估和监测供应商的质量和可靠性。
“制造”阶段包括将产品转换成成品以满足计划或实际需求的过程。生物制药行业Rita C.Peters最近的一项调查显示,质量源于设计(QbD)提高了工艺理解度(68.4%),提高了产品质量(66.7%),降低了产品质量变异性(57.9%)。近半数的行业报告提到生产效率有所提高。但是,差不多有32%的受访者没有实施QbD。没有实施QbD的原因包括缺乏来自监管机构的监督和指导(46.2%),没有获得过程或质量优势(30.8%),缺乏对QbD倡议的理解(23.2%)或认为它太昂贵了。其他还有一些因素包括流程稳健性,质量风险管理成熟度,产品复杂性增加以及缺乏国际统一的法规。
“交付”阶段由提供成品和服务以满足计划或实际需求的过程组成,通常包括订单管理,运输管理和分销管理。这一阶段面临的挑战包括供应链安全性,转型中的产品完整性以及分销信息的可视性。
总体而言,制药行业需要内化“整体可靠性”(即供应链始终如一的交付能力)是质量的关键部分。质量不仅仅是过程和方法,这也是关于可见性,信息,可预测性和管理它们的系统。提高可靠性的能力来自系统改进和产品特定改进。总体而言,制药行业的挑战并不是独一无二的。其他制造业也面临类似的挑战,他们的成功可以被借鉴。
技术的进步与挑战
药品制造商已经使用尖端的科学来发现药物,但在技术和效率方面,制药生产流程落后于其他行业。现在,该行业正在从批量生产转向连续生产(参见图2)。在新方法下,原材料被送入一个连续运行的过程。许多其他行业多年前就采取了这样一种连续的方法,因为它可以在不中断生产的情况下检查质量。这将生产时间缩短了几周,并大幅降低了运营成本。直到最近,制药公司已经以老式的方式制造了大量药物,这种通常是在不同的工厂以大桶的方式将成分混合在一起,且在每个步骤完成之前无法评估质量。
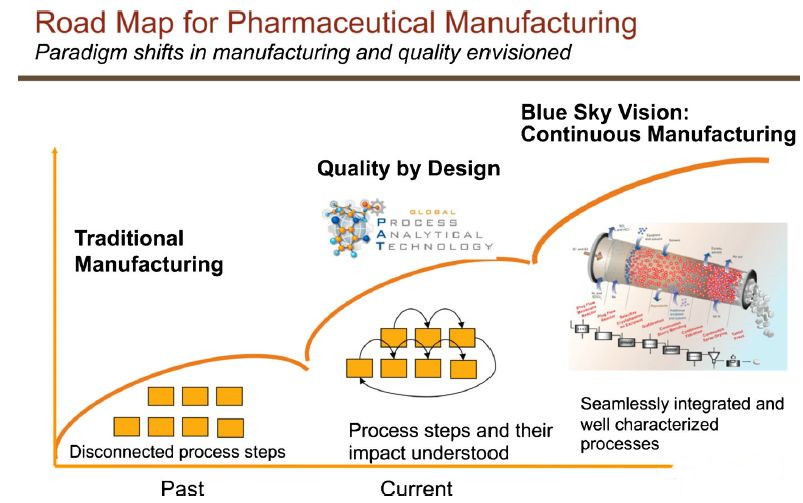
图2. 药物制造的路线图
在过去的十年中,药品制造方面出现了范式转变,从产品质量完全通过终端产品测试确认的固定流程转向质量源于设计(QbD)。QbD是一种基于系统科学和基于风险的药物制造方法,通过对产品和过程的了解,建立质量保证体系。连续制造代表了下一个模式转变,并通过整合和应用基于系统的方法提供了一个机会,以采用先进的制造工艺开发和控制系统来生产高质量的产品。这减少了由于生成不合格材料而导致的浪费。由于在其最终表现形式中,连续过程被设计为一个整体,原料药过程和药品过程之间的区别可能被消除。这种蓝图可以通过采用新颖的工艺技术来实现。
一个连续过程的显著好处是将化学操作和配方集成到一个解决方案中,从而实现一个在一端引入原料,另一端出来产品的恒定的,全自动化的过程。曾经被视为制造业创新的潜在障碍的FDA,目前正在积极推动和支持持续流程。FDA看到了提高药物制造整体质量和可靠性的机会,于2004年开始推动这种变化。事实上,在2015年,FDA批准了第一个包含连续生产过程的新药申请。
在全体会议上,Bernhardt Trout介绍了在麻省理工学院由他们小组完成的第一例端到端,集成连续制造工厂生产的药品。它从一个化学中间体开始,进行所有中间反应,分离,结晶,干燥和配制,从而在一个严格控制的过程中形成最终的片剂。该工厂提供了一个平台,用于在完全集成的生产系统环境中测试新开发的连续技术。此外,该工厂还提供了一种调查多个互连单元的系统性能的方法。
总之,监管机构,行业和学术界已经取得了重大进展,以支持和提高产品质量。随着OPQ的建立,QbD被业界接受,以及连续生产过程中的技术进步,这个阶段将为美国公众提供质量前所未有的药物。如果质量得到提升,设计和建设得当,这将是一项真正有益的努力,有可能有益于行业和患者。
新兴的监管举措
基于生物药剂学分类系统(BCS)生物等效性豁免
2000年8月,FDA发布了一项关于豁免体内生物利用度和生物等效性研究的指南。BCS是一种基于科学和风险的框架,根据其水溶性和肠渗透性对药物进行分类。当与药品的体外溶解特性相结合时,BCS考虑支配IR固体口服剂型吸收口服药物的速率和程度的三个主要因素:溶解度,肠渗透性和溶出率。在2002年,FDA发布了一项指导意见,建议食物效应生物等效性研究不需要在快速溶解的即时释放剂型中服用BCS I类药物。为确保准确性和一致性,FDA组建了BCS委员会,该委员会有责任和权力确定新药或仿制药的BCS分类。该委员会已将42种药物分类为BCS I类药物(即含有高溶解度和高渗透性药物的快速溶解,速释药物)。这一决定不仅有助于确保新药或仿制药的可用性,还为投资商节省数亿美元的临床研究费用。此外,FDA最近发布了一项指导草案,将生物等效性豁免延伸至BCS III类药物(即非常迅速溶解,含有高溶解度但低渗透性药物的速释药物),这将进一步加速药物开发并减少昂贵的体内研究。会议强调的一点是,该领域未来的工作重点应放在全球统一生物药剂学分类系统上。
药品生命周期管理-Q12
当涉及到批准后的变更时,行业和FDA(以及其他监管机构)面临着许多挑战。这些挑战对生命周期管理有直接影响,并可能导致(i)缺乏主动实施制造(和其他)改进;(ii)行业和监管资源使用效率低下;(iii)实施ICHQ8-Q11期望的效益和业务灵活性未得到充分实现; 和(iv)供应链中断和潜在的药物短缺。
2014年,在明尼阿波利斯召开的ICH质量战略研讨会上,研讨会参与者反映了自ICHQ8-Q11发布以来的进展。他们提出了一项为期5年的战略计划,包括制定药品生命周期管理的愿景和战略。在ICH2014研讨会上,ICH指导委员会赞同关于建立专家工作组(EWG)以制定新指南“药品生命周期管理的技术和法规考虑 - ICHQ12”的建议。ICH Q12是行业的优先考虑事项,并且旨在将更多的关注点放在生命周期的商业制造阶段,同时弥补上述指南中已经涵盖的开发阶段。如概念文件所述,ICH Q12是ICH“Q”准则的独特之处,因为它旨在解决管理产品生命周期中的技术挑战,同时也面临监管挑战。这些监管挑战包括一些复杂的监管流程,并非总是以科学和风险为基础。这些挑战包括明确监管承诺或既定条件的构成及其与控制的关系(如图3所示),作为生命周期管理推动者的变革和知识管理的最佳实践,以及探索协调全球数据需求以支持批准后变更的机会。
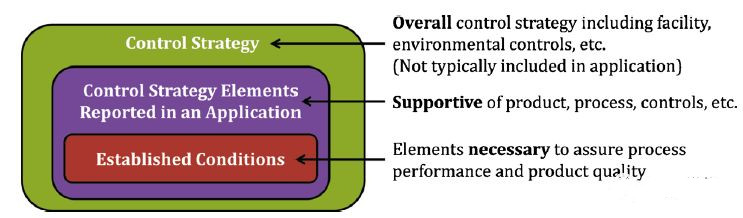
图3. 建立的条件及其与控件的关系
在这个关键阶段,在起草ICH Q12指南时,会议收到的反馈意见通知了Q12 EWG关于实现指南愿景的几个关键主题。这些主题包括(i)探索如何向FDA(和其他监管机构)提供行业变革管理系统可靠性的信心;(ii)更好地利用监管工具(例如,强大的药品质量体系(PQS),新的检验协议项目(NIPP),在检查之前或之后记录请求以及加强知识管理);(iii)将详细程度与已建立条件的管理结合起来,以将产品和工艺知识的风险和水平联系起来;(iv)为传统产品和仿制产品提供一条明确的途径,以实现Q12的机遇和利益。
溶出度测试
未来学家Joel Barker说:“在我的领域目前不可能做什么,但如果可能的话,将会从根本上改变它?”对于专注于固体口服剂型的制药领域的一个重要部分,答案是更好、更具预测性的溶出度测试。溶出是固体口服药物产品的最重要的质量特性之一。溶出度测试是确保开发和商业产品质量和性能始终如一的关键工具。对配方和/或制造工艺变化导致的相对产品性能评估也很关键。在提交监管申请之前,它指导配方和工艺开发,并便于评估关键工艺参数,设计空间,风险以及制定适当的控制策略。批准后,它可确保产品的批次一致性,并支持配方和制造过程中的建议变更。目前溶解方法的主要问题是它们可能过分或不足,或者最差,与体内性能完全无关。
“口服生物性能”的标准药典测试方法包括20世纪50年代采用的崩解测试,1970年采用的溶出装置1(篮式)和20世纪80年代采用的溶出装置2(桨式)。自那时以来,尽管在口服药物吸收的建模和模拟方面取得了突破,但溶出度测试领域的进展甚微。为了不同的目的,未来的溶出度测试可能需要转换为多种溶出方法(例如,适合目的的溶出方法)。出于质量控制的目的,溶出度测试需要简单,快速和经济。然而,溶出试验也需要反映体内的情况。目前正在评估各种非药典溶出方法,并将其用于学术界,工业界和管理机构,以追求更准确地代表目前已知的人类胃肠生理学的测试方法。目标是更好地评估体内性能。
FDA对修改溶出度测试使其更加具有临床相关性非常感兴趣。作为第一步,FDA最近发布了含有BCS 1类和3类药物的溶出度测试和规范标准指南草案。对于这些类别的药物产品,该指南推荐标准测试条件(即100RPM篮式USP装置1或75RPM桨式USP装置2),溶解介质(即500mL在37℃不含表面活性剂的0.01MHCl)和验收标准(即BCS 1类30分钟Q = 80%,BCS 3类15分钟Q = 80%)。该指导的科学依据是(i)与患者相关的溶出失败的风险低,(ii)生理学上更相关的介质和体积,以及(ii)满足溶出标准的需要可能产生体内等同性。
研究体外方法通常有一个目标:获得“最佳”体内释放速率,然后在产品的整个生命周期中保持期望的性能。在行业内有很多正在进行的研究以推进预测体内结果的体外方法,并制定用于延长释放产品的临床相关规格。实例研究包括(i)使用渗透系统快速评估体内活力并确认生物药物模型;(ii)将生物药剂学模型与数字剂型设计耦合以选择延长释放制剂组合物;(iii)放射性标记和闪烁扫描,以确定铅制剂并获得有用的体内信息; 和(iv)进行化学分析以评估基质对溶解的影响。剩下的挑战包括解决整个胃肠道的分裂问题。然而,这种解体的影响仍不明确。根据药物的基质和性质,其他方面(如扩散)可能更为重要。会议明确表达了这样的观点:只要有可能,体外质量属性都需要与体内性能相联系,以最大限度地降低对患者的风险,并确保一致的口腔生物性能。
质量指标
质量指标预计将在实现药品质量的理想状态方面发挥重要作用。质量指标程序在整个制药行业中用于监控质量控制系统和流程,并推动药物制造业持续改进。自2013年以来,FDA一直在与利益相关者讨论如何选择一组相互有用和客观的理想指标。FDA致力于支持医药制造业的现代化,并期望该计划与其他监督计划一起,通过识别和奖励超越最低质量标准的企业,鼓励改善该领域的行为和责任。
FDA于2015年7月发布了质量指标指南草案。本指南推荐了四项指标:(i)批次接受率,(ii)产品质量投诉率,(iii)无效的超标率,以及(iv)年度产品评估或产品质量评估。可选的指标包括高级管理人员参与,纠正措施和预防措施的有效性,以及过程能力/绩效(请参阅下面关于制造和质量保证下的过程能力的讨论)。FDA打算使用这些信息来提供更多关于产品和设施质量状况的信息; 在产品,现场和系统层面提供更多量化和客观的质量测量; 加强基于风险的监督检查调度模型; 提高检查的有效性; 并帮助确定导致供应中断的因素。此外,这些信息可能为帮助确定适用于批准后制造变更的报告类别提供依据。多家国际药品制造商已经对支持强制性计划的案件提交了正面评价。两家医疗气体协会甚至建议将范围扩大到包括他们的产品。但是,其他一些代表对指导草案的执行基调表示关切。
来自工业界和国际制药工程学会(ISPE)的代表都支持FDA在解决质量指标方面的努力,同时认识到跨行业的标准化是困难的。ISPE建议从FDA提出的三项指标开始:(i)批次接受率(按现场报告,按产品区分);(ii)产品质量投诉(仅由产品报告);以及(iii)无效的不合格率(由网站报告,按产品区分)。ISPE建议按时间顺序推迟年度产品评审或产品质量评审。ISPE建议现场报告,按产品区分,因为它更能代表行业目前收集高质量数据的方式,因此可以减轻项目启动的负担。
本次会议中的所有会议发言人都认为,每个数据点和度量标准的内容以及单个度量标准不能独立用于判断质量。其他讨论范围包括(i)按单位而非按批次计算产品投诉率;(ii)纠正措施和预防措施有效性/再培训率;(iii)年度产品检查时间率;(iv)供应链可见性(例如,合同制造属于报告的一部分);和(v)非应用产品的复杂性(例如,直到最终包装才能区分国内药品代码号,在柜台行业的这个细节处对上游指标报告提出挑战)。最终,质量指标计划将通过提高药物供应的质量和可靠性来改善患者获得重要治疗的机会。
法规提交,评估和检查
突破性治疗-CMC挑战
FDA安全与创新法案(2012年)第901和902节介绍了快速跟踪和突破性治疗指定。突破性治疗指定用于严重且危及生命的病症,并且基于风险的方法(例如,在阶段1或阶段2中获得的)的初步临床证据来授予。对于突破性药物,FDA允许缩短研究,开发,制造和处理时间,同时不会降低CMC质量预期。因此,在审查过程中采用了几种灵活的方法,包括滚动提交,补充,上市后需求和上市后承诺。例如,已经达成协议,即在初次申请时提交较少的稳定性数据,并在数据提供时提交。
对于FDA和行业来说,加速提交和审查都是具有挑战性的。对于FDA而言,(i)可用的CMC数据较少(例如安全性,稳定性,加工和制造);(ii)在应用程序生命周期中进行额外的修改;(iii)需要对设施进行早期识别和检查;(iv)增加治疗方案/扩大获取方式;(v)增加上市后的要求和上市后的承诺以弥补剩余风险。对于工业来说,它需要(i)高临床需求;(ii)详细的产品生命周期计划;(iii)预审批准检查准备情况;(iv)制定有意义的规范; 和(v)开发健全的制造工艺。减轻风险和解决意外问题的关键是发起人和FDA之间早期的开放式强度沟通。赞助商发现,在出现问题时,与FDA进行及时和有意义的沟通至关重要。在协同工作时,FDA和赞助商能够在突破性药物的整个生命周期中探索,排除故障并解决意外问题。在会议上,很明显,行业希望制定明确,一致,可预测和透明的政策和流程。这些应该与利益相关方的意见一致,将药品开发和商业生产计划与适用的监管途径联系起来。
预审批和监督检查
FDA对制造业务进行检查主要有两个原因:(i)在批准之前评估制造业务;(ii)通过定期评估所有生产设施来验证制造业处于控制状态。为此,可以执行预批准检查(PAI)。PAI顾名思义是评估(i)商业制造的现场准备情况,(ii)与市场营销应用程序的一致性,以及(iii)在现场生成的真实性,可靠性,和准确性。进行PAI的决定取决于设施,流程和产品风险。
PAI检查可以为FDA提供有价值的信息和保证,以确保任何新药的生产方式能够确保其安全性和有效性。PAI可以(i)更高效和更有效地解决应用程序异地审核期间发现的某些审核问题,(ii)提高审核人员对流程和产品的理解程度,以及(iii)对过程和控制策略进行实质性讨论(包括任何基于PAT的监控,模型维护和决策树)。PAI还为FDA专家提供了一个机会,可以更全面地评估与一般设施问题相关的标准申请中未包含的信息。特别是,这包括如何将拟议的新药纳入现有的非专用设施,包括讨论趋势,持续过程验证和风险管理。FDA也可以在批准后立即对设施进行检查,并在分销后不久检查,以核实包括控制策略在内的商业规模生产操作是否产生了设计和批准的药物。会议上关于PAIs最重要的讨论导致了以下建议:(i)来自不同学科的申请审查人员更频繁地参与检查,(ii)同一个检查团队对申请中引用的所有生产设施进行检查,(iii)FDA增加与执行设备检查的其他监管机构的协调,(iv)FDA在PAI结束时不发布书面的观察通知(FDA 483),以及(iv)FDA在设施检查之前提交问题。
进行监督检查,以验证药品(有效成分和成品)是否根据FDA关于最低质量标准(即当前良好生产规范)的条例进行生产。监督检查还为工业界提供了一个学习观察的机会,评估当前的实践是否符合FDA指南中的建议,并向FDA提供有关行业实践的最新信息。目前的监督检查重点关注CGMP违规行为,通常会导致需要进一步监管行动(例如警告,扣押,进口戒备和禁令)的确定。在会议上讨论的一种可能的不同方法是确定一个设施的整体质量能力(从低到高),以便在较低功能的设施中提供适当的监管干预,并降低较高功能设施的监管活动。
保证产品质量的理想监督检查可能会更好地认识和鼓励良好质量管理的两个基本要素,即(i)风险得到系统理解和减轻;(ii)风险管理和确保药物质量稳定的努力得到促进和激励。这需要行业和监管机构之间采取全面合作的方式。目前监督检查所关注的问题包括:(i)主动提高制造质量缺乏明显的激励措施;(ii)监管机构有限地使用基于风险的方法导致行业(和监管)资源的低效使用;(iii)在监管检查(以及其他审查和执法纪律)中的不一致,以及(iv)监管机构之间缺乏协调一致。针对未来方法的建议包括(i)激励高功能制造业务,(ii)根据航空安全报告系统改进共享质量问题报告系统,以及(iii)考虑某些质量标准,如海产品危害分析中的关键控制点程序。FDA正在制定更加结构化和基于问题的检查计划,以支持对每个工厂的质量管理体系(即“新检验协议项目”)进行更客观的分类。
基于风险的监管方法
基于风险的监管方法的理想状态涉及行业与FDA之间的公开交流。除了持续开放的沟通之外,应用程序还可以为风险的不确定性以及特定产品的质量控制策略的设计,开发和稳健性提供额外的透明度。本着透明的精神,工业界应该愿意与FDA分享风险评估或风险评估方法,但这种公开不应受到惩罚。另外,行业和FDA的重点应放在风险和质量上,而不仅仅是合规性。
目前以风险为基础确保产品质量的方法还远未完善。产品召回和药品短缺的数量令人无法接受,而且行业或监管机构没有足够的透明度。 FDA想知道该行业如何进行风险评估。同时,该行业关注监管评估/检查和全球分歧方面的不一致。更好地理解产品质量和控制策略将增加FDA对行业质量管理能力的信心。
从现在到未来转型的障碍包括:(i)文化惰性;(ii)激励不足;(iii)缺乏风险评估工具,技术和系统的标准化; (iv)行业与监管机构之间缺乏信任;(v)缺乏公开的沟通和相互承认;(vi)缺乏生命周期重点; 和(vii)繁琐的提交格式。短期目标是通过以下方式提高双方的透明度:(i)为行业提供明确的期望,(ii)确保适当的控制策略到位,(iii)区分风险与表征不确定性,(iv)分享风险评估技术以提高FDA对数据的信心,以及(v)确定和确认风险评估技术的可预测性。长期目标是建立行业与FDA之间的合作关系。双方的透明度将增加信心和信任,并规范风险评估。然而,双方需要有相同的意图(例如,操作,愿景,创造力和质量标准)。双方应重视患者安全并共同努力创建健全的评估工具和系统。
质量风险管理
风险管理推动质量管理体系(QMS)的重点,帮助确定这些活动的努力水平,并支持基于风险的质量管理决策。将风险管理整合到质量管理体系中可以帮助提高效率和效率,并减少伤害率,积压,库存,资金和损失(如图4所示)。质量管理体系包括质量缺陷的开发,评估,审核和检验,定期产品评审和变更控制。
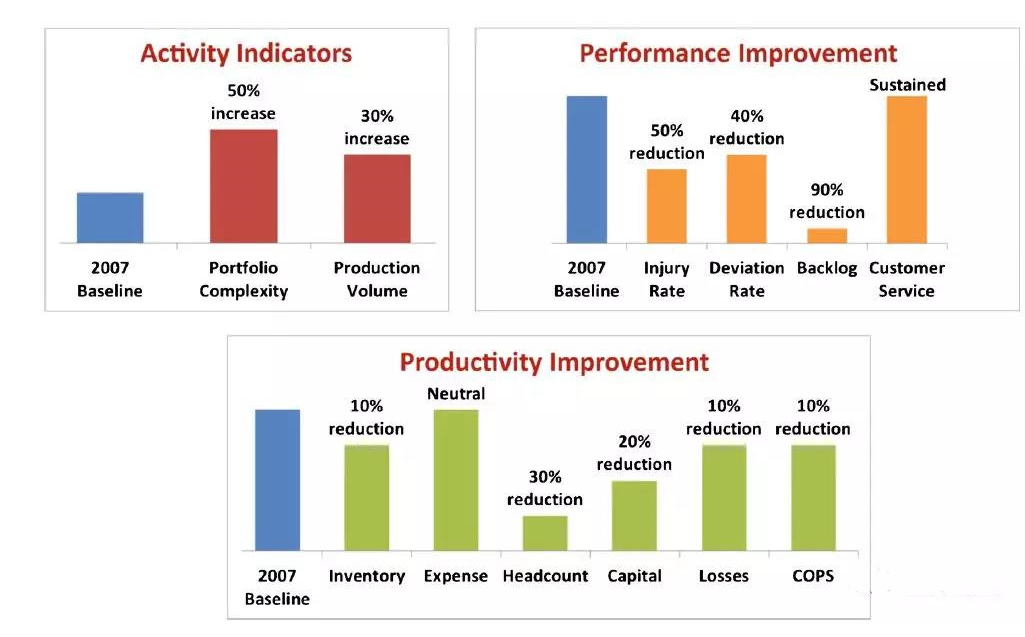
图4.质量风险管理和过程能力
通过专注于将质量风险管理整合到质量管理体系和追求过程能力中,Lilly公司已经实现了改进,包括从2007年到2013年减少了50%的受伤率和40%的偏离率。
质量风险管理(QRM)用于指导开发强大的控制策略,以确保建立和实现关键质量属性(即风险评估)。应该定期评估过程的能力和控制策略的可靠性以重复提供优质产品,以确保持续的适应性(即风险评估)。通过以下方式将风险管理纳入制造管理:
●正确评估产品,站点和系统以获得风险的全面评估并维护风险文件;
●基于生产的更新(例如,不合格,过程变更和供应商变更),市场(例如投诉,不利事件和客户询问)以及行业和法规变化(例如新的要求和类似市场产品的信息);
●长期规划活动(例如,商业战略,政策,投资组合和企业目标),中期活动(例如运营战略,关键目标,全球治理和绩效目标)和短期活动(例如资源部署,车间执行,过程控制和监控);
●管理参与,升级,决策和审计。
QRM范围应该包括前瞻性的最坏情况,从而产生知识以理解风险和/或实施控制以降低风险。特别是,领导应该(i)关注与人类行为相关的风险;(ii)充分理解制造产品的个人的观点;(iii)实施适当的权力,激励措施和控制措施,以缓解质量问题。
QRM在监管行动发生后纠正合规问题的重要性是至关重要的。QRM应该跨系统集成,以确保对整个制造过程进行正交评审(例如,设置每个站点相同以维持质量控制水平)。这种整合应该可以减少混淆,并使用通用的质量实践简化质量管理体系的功能。可以通过继续改进基于常见缺陷的质量控制策略并创建全球标准以在整个过程中实现更多责任来帮助QRM。很明显,治理对QRM的成功非常重要。
FDA综合质量评估
OPQ开发并实施了基于团队的综合质量评估(IQA)。这种方法最大限度地提高了每个团队成员的专业知识,并提供了与药物物质,药物产品,制造过程和设施相一致的以患者为中心和基于风险的药品产品质量建议(如图5所示)。IQA团队旨在通过PDUFA /GDUFA时间表内的高度协作模式进行工作。IQA团队的审核人员将重点放在与患者需求相关的质量风险上,并在缓解临床表现风险方面传达信息请求或缺陷。审查是在考虑生命周期方法的临床和监管框架的情况下完成的。开放的沟通和质量风险对话以及与患者的联系对于IQA方法的成功至关重要。
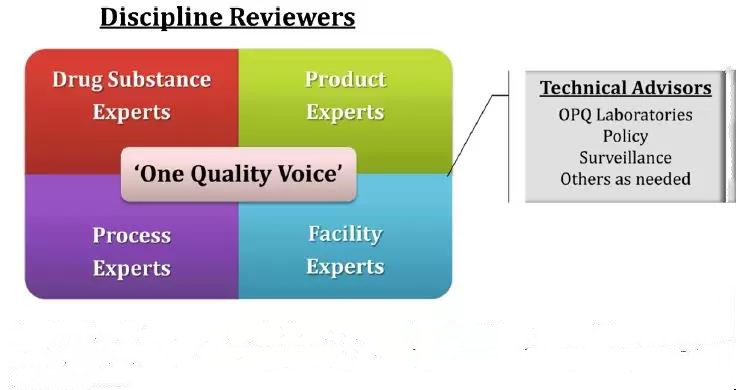
图5. FDA团队的综合质量评估
基于团队的综合质量评估由药物物质,药物产品,工艺和设施的学科评估者组成。正式的风险评估用于提高审查和检查的效率和有效性。审查与检查相结合可以为工厂的可接受性和应用程序可审批性做出更明智的决定。基于团队的IQA方法来自新的和非专利药物评论。对于新药,它是从QbD试点和基于团队的突破性意见审查演变而来的。对于仿制药,它从2010年原料药/药物产品试点的整合开始发展。它作为OPQ重组和GDUFA实施的一部分,以及实时通信的使用而发展。2014年10月1日之后提交的所有新的通用申请以及CDER管理的生物制剂许可申请(BLA)都已使用IQA方法进行了审核。事实上,最近持续生产药品和3D打印药品应用的批准是IQA方法的结果。
FDA IQA的目的和益处清晰地被业界所理解和支持。2011至2015年批准的新发展区评估显示,共同缺陷领域是过程控制和规格(共有60%的缺陷)。由于实施IQA,观察到了一致的药品质量评估。在诸如关键性,过程描述和控制策略等方面存在改进的对准。不过,还有进一步对话的机会。业内人士指出,信息请求应被视为提交信息中的缺陷,而不一定是公司发展计划中的缺陷。对于ANDAs,观察到总数和问题多样性的增加(即问题显然是由一个团队产生的,而与单一的审查者方法更集中的问题相比)。这些问题在产品和流程的理解方面是本质性的。ANDA赞助商对所有风险的缓解策略都有非常高的期望。所有的ANDA都需要QbD原则的实施。
FDA和工业界都希望代表病人期望药品的质量。预计将有更高效,透明和基于风险的沟通将质量与临床表现联系起来。需要进一步讨论如何使质量管理体系信息对监管机构透明,以建立信任并管理审核人员与检查人员之间的模糊界限。在会议上,对IQA流程的改进建议包括:
●通过IRs /缺陷进行的FDA沟通应该明确问题背后的基本原理;
●应用程序团队领导应该在巩固问题和确保应用程序得到适当支持方面发挥更大的作用;
●保持并拓展FDA与行业之间的对话。 FDA可以提供风险评估的最佳实践和/或期望(例如,提供多少信息以及在哪里提供)?
●在开始NDAs提交审核后不久,面对面会议的可能性;
●鼓励业界要求澄清那些不明确,不受支持或可能会产生意想不到的大量回应的问题。
产品和工艺开发
含有纳米材料的复杂药物制剂的表征
FDA正在接受并批准越来越多的含有纳米材料的复杂药物制剂的申请。这些产品是以与不含纳米材料的药品相同的方式进行管理和审查的。行业和监管机构对这些产品的开发和监管都面临挑战,这通常源于确保适当和适当的表征以保持产品质量。特别是,确定哪些方法将用于表征是一个很有争议的话题。
尽管任何产品的关键质量属性最终都是针对特定产品的,但尺寸分布是纳米材料表征和控制的一个引用广泛的属性。含纳米级材料的不同配方的尺寸分布已被证明会影响产品性能,因此通常在产品开发期间以及在发布和稳定性规格中对其进行测量。动态光散射(DLS)是工业界和FDA都认可的最常见的上浆技术。然而,为了确定尺寸分布,这种技术必须结合另一种补充方法来充分表征纳米材料的尺寸分布。FDA和业界同意,全面的粒度控制策略对于含有纳米材料的产品是必不可少的。
尺寸不是纳米材料药品唯一的关键质量属性。其他属性(包括非纳米级属性),如形态学,药物释放和表面电荷常常影响产品性能。关键质量属性的确定最终将是产品特定的,并且建议行业和FDA之间进行讨论以澄清关键质量属性及其测量,以加速这些复杂配方的开发和批准。
生物相似产品评估 - 相似性如何?
“生物制剂价格竞争与创新法案”是2010年3月23日签署的“患者保护和平价医疗法案”的一部分,修订了“小灵通法案”,制定了生物制品的许可证途径,证明其生物相似性或可互换性, FDA许可的生物参考产品。FDA发布了一系列指导性文件来帮助开发生物仿制药产品。 2015年3月6日,FDA批准了第一个生物仿制药产品,Sandoz的Zarxio,与Amgen的Neupogen生物仿制药。尽管如此,FDA和业界代表也提出并讨论了生物仿制药产品开发方面的挑战。
产品的开发是一个连续的过程,因此,应该在每个阶段评估分析相似性(例如,IND前,IND启用,药代动力学/药效学研究和支持执照)。使用多个参考批次,在一些例子中为20-30批次,跨度为4 - 5年。关键临床研究中使用的许多应该是分析相似性评估的一部分。产品开发过程中出现的问题可能与参考产品质量属性的潜在变化有关。因此,如果在生物仿制药的早期开发过程中发生转变,可以将新批次整合到开发计划中,并调整过程以匹配参考产品的质量属性。对于一个成熟的项目,业界认为生物仿制药应该保持原来的目标概况。当这样的问题出现时,建议与FDA讨论。另一个潜在的问题是可以通过仪器或人员变化引入的分析漂移。通过使用参考标准和适当的分析适用性标准可以减轻这种漂移,突出了一致的参考标准材料和双层参考标准体系的重要性。
使用统计工具评估分析相似性是会议上的另一个讨论主题。FDA的目标是使项目成功并激发公众和医疗保健提供者社区的信心。行业代表强调了一些挑战。分析相似性评估中使用的批次数量很重要,因为少量批次可能不足以捕获产品的可变性。FDA建议根据质量属性风险等级的统计方法,将风险等级与统计等级相关联(即1级等同性测试,2级质量范围和3级视觉比较)。并非所有高度关键的质量属性都将分配到第1层。风险评估是特定于产品的,属性的分配也是特定的统计层。就等效性测试而言,当等效裕度非常严格时,行业很难针对制造范围。总之,FDA需要对分析相似性进行统计评估。
可口性和可吞咽性
患者对药品的接受程度以及对规定治疗的依从性对于达到预期的治疗效果至关重要。口感是口服药物产品的关键质量特征,并且包括诸如质地,味道,气味,适口性和可吞咽性的评估范围。对于儿童人群来说,口感尤其重要,因为与成人相比,患者对剂型的接受程度可能更难实现。口感评估可以在味道小组中进行(例如,成人和儿科患者的感觉方法),也可以使用特定的工具和技术在体外进行。
会议强调了从应用描述和改善食物口感的方法中学习和利用机会的可能性。它侧重于摩擦学,该技术捕获有助于口感的过程和使用电子传感器(例如电子舌)在制剂开发中的适口性和味道掩蔽。自20世纪60年代以来,为了解消费者对食品和饮料口感的认识,不断开发出大量的知识,专业知识和技术。这些知识已被用于设计和优化消费者可接受的食品(包括液体)。用于量化和翻译消费者体验的食品中使用的基本措施(例如硬度,粘度,弹性和剪切应力)也在用于评估药品属性的药剂学中测量。
在食品工程中,摩擦学有助于理解食物的口服加工以及质地和口感。摩擦学捕捉口感的物理基础,包括诸如粘度,唾液相互作用,吸附,表面性质和磨损等过程。它是评估食物和饮料的体外口腔崩解轨迹的重要工具。品味感知的复杂性以及对可口性/口味的贡献者涵盖从与药品直接相关的因素到诸如文化背景和饮食偏好等外在因素的广泛范围。虽然味觉小组可以解决某些感官问题,但味觉小组中的配方的常规测试,特别是特殊人群,如儿科和老年病学,将难以进行。电子舌(e-tongue)最早是在20世纪80年代末/ 90年代初开发的,目的是支持配方的开发/改进。电子舌的典型使用领域是掩味和配方开发,评估预测能力的比较研究以及苦味评估和衰减。此外,电子舌用于表征固体口服剂型的掩味属性(例如掩味作为时间的函数)和作为确定制剂掩味持续时间的工具。电子舌在食品和制药行业的应用正在持续增长,尽管挑战(例如,传感器响应,参考标准,电子舌/味觉传感器与嘴巴的液体体积差异等)。
会上讨论了几条关键信息和建议。关于评估口感(例如质地和摩擦学)和适口性(例如味道掩盖和电子舌)的科学和方法的讨论,用体外方法获得的信息在早期制剂开发(即筛选)中是最有价值的。此外,没有一种方法可以取代体内评估。尽管所有方法都是互补的,但方法/工具在正确使用和用户管理期望时会带来最大价值。与其他行业(如食品,消费者,人类和动物卫生保健),学术界和管理机构持续对话,可以利用跨学科学习的配方开发机会。需要更多的场所进行公开讨论和分享知识和经验。还需要继续研究和合作如何进一步应用体外方法来了解和改善口感和味道。
含量一致性
剂量单位的均一性可以通过含量均匀性(CU)或基于产品中药物负载的重量变化来证明。确保CU的适当方法对于具有低载药量和/或狭窄治疗指数的产品特别有意义。2013年回了“工业 - 粉末混合物和成品剂量单位 - 分层过程剂量单位抽样和评估指南”草案,因为它不再反映FDA目前的想法。由于缺乏统计抽样计划,美国药典(USP)<905>剂量单位的均一性仅对受试批次提供了有限的保证。因此,迫切需要替代现有的CU方法和分层抽样。
该行业需要灵活的样本规模和验收标准,特别是考虑到过程分析技术(PAT)和连续生产的采用越来越多。USP<905>规定的零容忍标准是非生产性的。USP认识到这些需求和挑战,并正在积极探索如何考虑表明最终产品符合性可能性高的制造数据。例如,USP专家小组和委员会成立,以讨论实时发布测试和大型“N”采样。
同时,ISPE根据ASTME2709 / E2810规定的准则提出了一个框架。这样的框架提供了(i)增强了从该批次抽取的未来样品符合USP<905>的信心和(ii)包含制造过程的所有三个阶段(即过程设计,过程限定,持续过程验证)。此外,研究表明使用PAT确保和增强混合和内容均匀性的显著优势。PAT工具不仅可以提供深入的产品和过程理解,还可以促进适当的抽样并增强统计信心。关于抽样的统计学考虑和确定接受标准,可采用不同的抽样策略(如简单随机抽样,分层抽样和系统抽样)。需要注意的是,随机抽样可能无法提供位置变化之间/之内的估计。数据的分布需要确定,因为它将决定数据分析方法。验收标准应具有临床相关性;它需要符合所需的产品质量水平。例如,低载药量和高效产品的验收标准可能与高载药量产品的验收标准不同。早期与监管部门讨论内容一致性验收标准和抽样计划非常重要。一旦被认为可接受,当采用更先进的制造和过程控制时,可以在产品的整个生命周期中更新或修改此类验收标准和抽样计划。
技术转让/放大科学
从实验室和中试规模的研发工作转向商业化生产规模可以按照预算进行,并且可以在预算范围内进行,否则它可能会变成昂贵的挫折。如果出现过程控制和产品质量问题,可能会出现意外成本,推迟发布,收入损失和药物短缺。然而,通过采用以基础药物科学,工程专业知识,创新材料科学方法学和先进的基于计算机的预测工具为重点的多学科方法,可以大大提高成功扩大规模和向商业工厂转让技术的可能性。
在会议上,案例研究证明在粉末和颗粒行为以及单元操作(如流化床制粒,双层压片和锅包衣)等领域有效使用机械和预测建模和模拟。还介绍了在产品生命周期和风险缓解策略期间支持根本原因分析的模型和模拟。
实现机械产品和过程理解的全面实验设计(DOE)在存在大量变量时可能是昂贵且不切实际的。放大和缩小规则以及标度独立参数的识别是有用的。此外,数学建模,仿真和高级分析的应用可以深入了解材料和结构的行为,从而实现成本有效的制造工艺设计和优化。例如,代替大规模DOE运行涉及十个以上运行参数,商业运行可以验证模型预测。因此,放大风险得到缓解。
由于建模实验中使用的材料更少,商业工厂时间减少,同时预测商业工艺参数,因此实现了成本节省。但是,建模和模拟的有效使用需要熟练的工作人员。制药行业可以从其他行业招聘,这些行业通常使用这些技术来引入基本技能。从监管角度看,这些技术受到高度鼓励。预测模型和仿真的使用是产品和工艺开发的可接受方法,以及支持实时发布测试(RTRT)和连续制造等创新技术的制造。
通过提供足够的信息和数据支持扩大规模的过程,监管审查变得更为有效,IR循环得以最小化。申办者应咨询有关模型信息的类型和范围的监管指导,以包含在监管意见书中。这种信息的一个例子是FDA-EMAQbD材料。模型的标准化在制药行业并不常见,但共享模型和开发模型标准可以帮助行业开发工作,并便于监管机构审查提交。在研究和开发中更多地采用多学科方法进行预测建模和仿真,将会提高对科学产品和过程的理解。最终,这将导致成本效益,成功的技术转让和扩大规模,并提高整体制造系统的信心。
制造和质量保证
如何预防,检测和响应数据完整性事件
数据完整性是数据集合完整,一致和准确的程度。数据完整性提供了药品质量的基础。没有可靠的数据,二十一世纪制造商生产高质量药物而没有广泛监管的愿景是无法实现的。违反数据完整性侵蚀了监管机构和公众的信心。关于数据完整性的两个主要关注领域是(i)作为检查结果向卫生当局提供数据,(ii)提供数据作为监管提交的一部分。数据完整性问题可随时随地发生在任何公司。数据可能因不稳定和无意错误而不可靠。一个错误模式可能会引起关于数据整体可靠性的问题。数据完整性问题的常见原因包括:
●质量体系对生产操作和流程没有足够的控制和监督;
●业务和业绩压力,如时间压力,库存需求以及满足指标/目标的愿望;
●文化压力,例如蓄意企图隐瞒错误和偏离问责的愿望;
●流程和技术不足,例如不安全的计算机系统和缺乏培训。
●为了应对数据完整性问题,公司需要进行全面调查,以发现根本原因,确定缺陷记录实践对发布的药品质量的影响,并制定管理策略以详细说明公司的全球纠正措施,以及预防性行动计划最后,FDA可能会重新检查该公司,以防止数据完整性问题的再次发生。
总之,公司应该保持准确性,可靠的设计,记录系统的一致性,以及纸质文件系统和计算机系统。纸质和电子数据都应该进行控制,以确保整个数据生命周期的真实性,完整性,机密性,可检索性,准确性,一致性和完整性。应该有手写和电子签名控制措施,以确保法律约束力。最终,有效的质量体系和管理治理可确保数据的完整性。
连续制造
连续制造是一项新兴技术,为所有利益相关者提供机会:患者,监管机构和行业潜在的好处包括:(i)通过采用精确控制,降低可变性和可靠性;(ii)由于减少了设备占地面积并提高了工艺效率而降低了成本;(iii)每单位剂量的处理时间减少(分钟与天数);(iv)消除导致供应链更加敏捷和响应的放大瓶颈; (v)提高对药物短缺,紧急情况和患者需求作出快速反应的能力,以确保持续供应高质量药物。连续生产的实施确实给行业和监管机构带来了挑战,但质量风险管理为识别和沟通解决这些挑战的方法提供了一个框架。
深层过程理解为识别和评估危害和失效模式提供了基础,并为设计控制措施以减轻这些风险提供了科学基础。对过程设计和控制策略开发的理解的关键领域之一是对物质流的理解。系统动力学知识可以用来预测干扰在整个过程中的传播方式。通过这种方式,可以使用系统动力学知识来跟踪和分离符合性和不符合的产品。捕捉对系统动力学的理解可能包括过程模型的开发。
应该设计一个连续过程的控制策略,以缓解随着时间的推移而产生的潜在变化产品质量风险。建立控制状态的标准取决于控制策略的实施选项(图6)。对于连续制造,控制策略可能需要整合更先进的方法来减轻已识别的风险,例如(i)建立控制状态标准(例如启动和关闭);(ii)过程监测(包括PAT);(iii)过程控制(包括基于模型的控制);(iv)对不合格产品进行材料跟踪和转移计划; (v)分析趋势和持续改进的大数据集;和(vi)实时发布测试。控制策略的设计应确保在一定范围的生产时间段,材料处理量或生产变化(例如不同批次的原料)内的特定限制内具有统一的特征和质量。因此,控制策略为建议的批量定义提供了灵活性。制造商可以根据特定的流程和驱动程序应用各种批次定义,并且仍然能够遵守适用的法规。
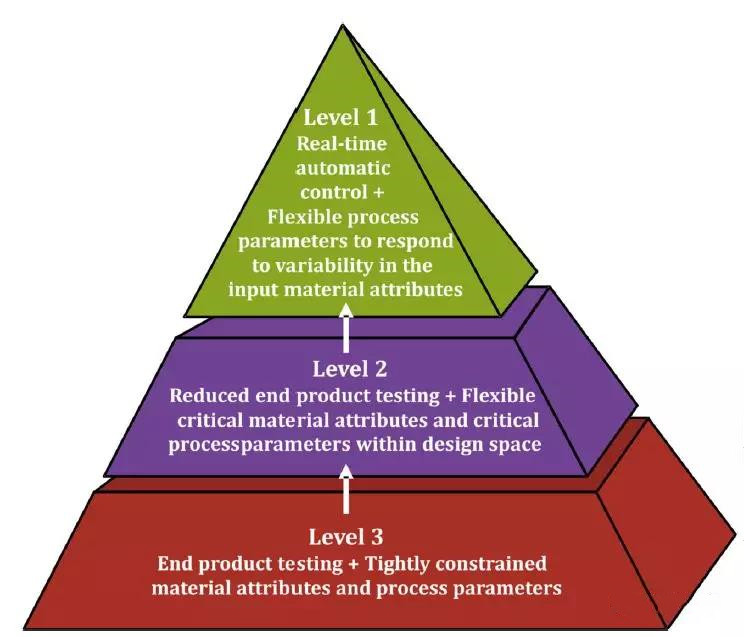
图6.控制策略实施选项
有三个层次的控制策略实施:1级—主动控制系统,实时监控过程变量和质量属性(依赖于主动过程控制系统); 2级—在确定的范围内操作(多变量)并通过最终测试或替代模型(依赖于过程监控和不合格材料的转移)进行确认; 3级—在不进行重要的最终产品测试的情况下,不可能在连续制造中解决自然变化的操作上可行。
但有人指出,连续制造的监管预期与传统批量制造有关科学和基于风险的方法和过程控制相同。对话和行业与监管机构之间的协调对于成功实施而言非常重要,并且早期与FDA进行接触有很多机会。虽然已取得了重大进展,但一些监管和质量方面仍在发展,因此仍有工作要做,例如:
●持续过程验证与验证活动的应用;
●集成的产品规格和档案内容用于集成的端到端流程(即从原材料到药品);
●需要评估现有具体指导的应用(例如,SUPAC指导);
●确定保质期的开始。
如何使用过程能力进行监控,控制和提高产品质量
一种高质量的药品被定义为一种无污染的产品,并可重复性地提供标签中承诺的治疗效益。免受污染主要是CGMP的关注点,而重复性地提供标签中承诺的治疗效益基本上是QbD的重点。因此,药品质量可视为QbD(科学)和CGMP的一项功能。QbD的目标包括:(i)在保证临床表现和提高过程能力的基础上,实现有意义的产品质量标准;(ii)通过加强产品和工艺的设计,理解和控制以减少产品变异性和缺陷。
过程能力被定义为消除外部影响后的自然或未受干扰的性能。统计控制状态(即稳定状态)意味着该过程没有表现出可检测的模式或趋势,因此数据中看到的变化是由于随机原因造成的并且是该过程固有的。过程能力是产品质量的领先的有用指标。它代表了特定过程在所有特殊原因被消除时可以表现得多好。过程能力也与供应链管理有关系。它可以用作供应链可靠性的指标,并通知库存管理。
衡量和实现强大的过程能力需要系统的方法。正如ICH Q10所阐述的那样,质量体系支持实现产品实现,建立并保持控制状态并促进持续改进的目标。持续改进的理念已被描述为卓越运营。实现卓越运营的基础是对质量的关注,随后在可靠性,速度和最终成本方面带来益处。
企业认识到理解和控制流程和产品变化的好处。可以使用过程平均值和最接近的规格限制之间的标准偏差数来分析许多不同行业的制造。这种处理能力的衡量标准往往是西格玛的价值。制药行业历史上生产时间为一至两个西格玛,重点关注合规性和满足规格要求。然而,由于最近的质量举措,六西格玛现在可能在制药行业实现。事实上,一些公司,比如Lilly和Amgen,正在达到或努力实现六西格玛。企业正在以更少的错误,更快的周期时间/更高的生产力以及更少的浪费/损失实现收益(如图7所示)。要实现较高的西格玛绩效需要时间,并需要领导层持续支持改善表现不佳的产品和流程。开发深入的技术理解和控制以及完美执行和人为错误预防是成功的关键因素。在实现高西格玛方面存在很多挑战,包括通常基于有限的过程能力数据,允许确定稳态的少量批次以及制造过程和分析方法的投资和法规变更而设定的监管规范限制。行业和监管机构之间强大的合作伙伴关系以消除障碍是实现最高效制药生产愿景的重要组成部分。
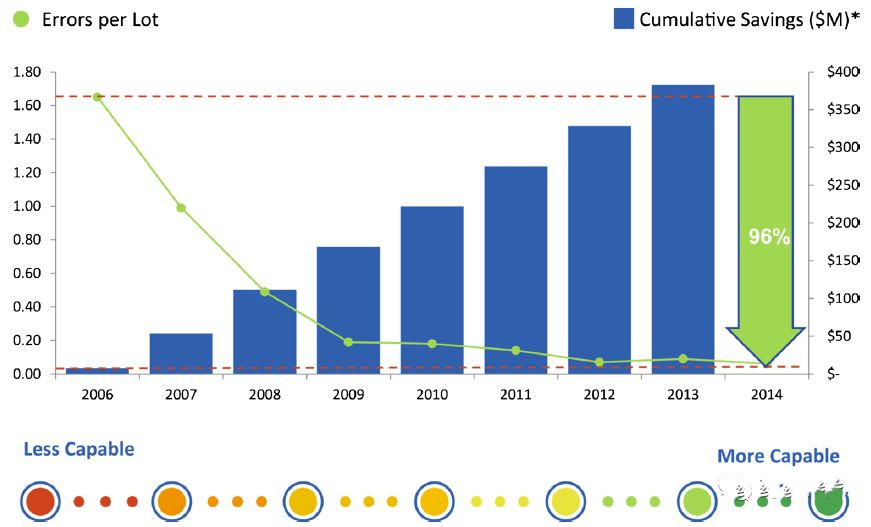
图7.六西格玛性能的好处
如何识别关键质量属性和关键过程参数
在确定过程中真正关键的因素时,必须从“质量目标产品概况”(QualityTargetProduct Profile,QTPP)开始“以最终目标开始”。 QTPP前瞻性地总结了药品质量,安全性和有效性的要素,从而形成了关键质量属性(CQA)发展的基础。然后使用CQA进行设计和优化决策,并确定关键材料属性(CMA),关键工艺参数(CPP),并通过连续的风险评估和结构化试验来优化控制策略。
最近的行业案例研究集中在基于CQA和机械过程和产品理解的CPP识别上。这些研究表明,关注一个产品和流程单元操作以评估控制空间可能会产生误导,并且在争取对产品和流程进行更深入的机械理解方面取得了最好的结果。其他行业的努力侧重于开发利用统计工具进行一致性的方法,同时仍然纳入科学判断和控制策略的整体观点。在利用这种统计方法时,重要的是要确定CPP-CQA关系不仅具有统计显著性,而且具有实际意义。与NDA产品开发相比,仿制药赞助商通常面临完全不同的时间表和驱动因素。在通用行业,利用已形成文件的先验知识是有利的,QbD的实施已被证明是科学和战略性的,应该完全集成到产品开发中。
声称“由于所有关键加工步骤的固定材料属性和工艺参数,所有药物质量属性都不重要”的药品赞助商经常会听到FDA的回应:“所有材料属性和工艺参数都可能很关键,因为有限的可变性来源特征描述以及对CMA和CPP对药品CQA影响的认识不足”。相比之下,赞助商通过在线或在线测量对CQA进行重要控制(例如通过近红外光谱)会发现FDA将重点关注关键步骤和中间体的控制(例如,使用NIR测试方法)。
总结
2015年10月推进产品质量的FDA /PQRI会议为管理机构,制药业和学术界之间交流关于药品质量的想法提供了一个论坛。2015年会议的主要议题是(i)新兴的监管举措;(ii)监管报送,评估和检查;(iii)产品和工艺开发; 和(iv)制造,风险管理和质量保证。随着包括监管,工业和技术要素在内的产品质量的强大进步,正在迅速提高药品质量的时代正在进行。在会议上,所有会议都贯穿了一个主题:监管机构,行业和学术界代表最终利益相关方即患者对药品质量的愿望保持一致。
转载药事纵横
Copyright Bayeebio Biotech (Shanghai) Co., Ltd. Shanghai 沪ICP备16015574号

