5月14日,UCB宣布现已获FDA批准,BRIVIACT?(布立西坦)http://www.bayeebio.com/products_detail.aspx?productsid=87&productscateid=89&cateid=89?口服制剂可用于4岁及以上患有部分发作性癫痫患者的单药治疗或辅助治疗。癫痫是大脑的一种慢性神经疾病,是全球第四大最常见的神经系统疾病。在美国,有超过340万人患有癫痫。癫痫发生在所有年龄段,且不分种族和性别。 约三分之一的癫痫患者目前生活在失控性癫痫发作状态,小儿癫痫是儿童和年轻人中最常见,最严重的神经疾病,影响美国近470,000名儿童。
该项批准,为临床医生提供了将BRIVIACT作为片剂或口服溶液为儿科患者的使用提供了灵活的给药方式,这是治疗儿童时需要考虑的重要因素。
由于BRIVIACT注射剂的安全性尚未在儿童患者中确定,BRIVIACT注射液仅适用于16岁及以上患者的局部发作性癫痫的治疗。目前国内仅有原研公司的进口注册,尚无仿制药注册申请。该新适应症的获批,根据总局《关于鼓励药品创新实行优先审评审批的意见》(食药监药化管〔2017〕126号)的政策,无疑为国内仿制药申报申请加速审批提供了可能。
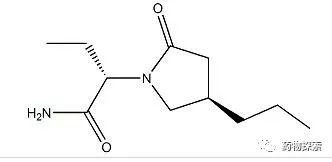
布瓦西坦结构式
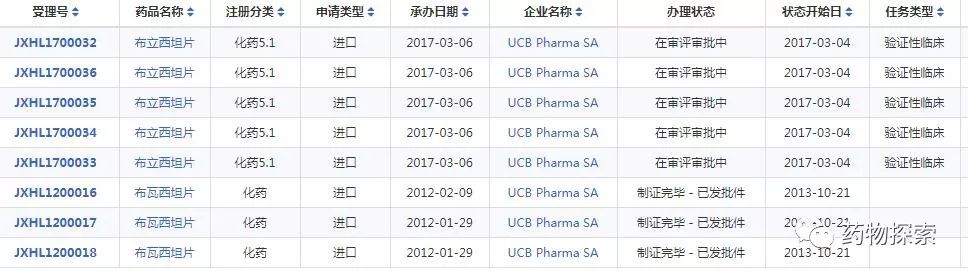
国内申报情况:
原创:药物探索
