诺和诺德于当地时间2018年11月23日宣布,该公司旗下口服GLP-1受体激动剂Semaglutide的最后一项全球性Ⅲa期临床试验(PIONEER 6)到达其非劣性终点指标。
总部位于丹麦哥本哈根的全球糖尿病巨头诺和诺德公司于当地时间2018年11月23日宣布,该公司旗下口服GLP-1受体激动剂Semaglutide的最后一项全球性Ⅲa期临床试验(PIONEER 6)到达其非劣性终点指标。该项双盲试验共纳入了3183名易发生心血管事件的2型糖尿病患者,并考察了受试者在标准护理的基础上分别添加口服Semaglutide 14 mg或安慰剂治疗的心血管安全性。在中位16个月的随访期内,共发生了137例重大不良心血管事件(MACE)。该项试验以首次发生的心血管死亡、非致死性心肌梗塞与非致死性卒中所构成了MACE复合结局作为其主要的终点指标,而口服Semaglutide与安慰剂相比的危险比为0.79,代表着口服semaglutide组的MACE发生率比安慰剂组低21%,但这一差异未达统计学显著性。
Semaglutide是由诺和诺德公司开放的新型长效GLP-1受体激动剂,于去年年底获得FDA批准,以每周皮下注射1次的剂量用于2型糖尿病的治疗。FDA的DrugLabelling中收录的SUSTAIN 系列试验证实Semaglutide的降糖与减重效果优于安慰剂、西格列汀、缓释艾塞那肽与胰岛素等对照药,从而曾经一度被誉为史上最好的降糖药。除了皮下注射剂型,诺和诺德还采用N-(8-[2-羟基苯甲酰基]氨基)辛酸钠(SNAC)作为吸收促进剂,开发了Semaglutide口服剂型,并在PIONEER系列试验中证实了口服剂型的安全性与有效性。
本文对2018年6月以来PUBMED数据库中收录的Semaglutide临床及其相关研究进行了总结分析。
1特殊人群的药代动力学、安全性与/或耐受性研究
(1)考察肾功能状态对口服Semaglutide药代动力学、安全性与耐受性的影响的试验
【研究机构】诺和诺德的研究。
【出处】Clinical Pharmacokinetics 杂志2018年第57卷第12期。
【试验设计】单组试验。
【受试者基本信息】24名肾功能正常者、12名轻度肾功能损伤患者、12名中度肾功能损伤患者、12名重度肾功能损伤者与11名需要血液透析的晚期肾病(ESRD)患者。
【干预方法】空腹状态下口服Semaglutide(以SNAC作为吸收促进剂,5 mg qd×5天,而后10mg qd×5天),而后继续空腹30分钟。
【主要结果】受试者肾功能状态对其体内的Semaglutide暴露水平与半衰期(几何均数范围在在152~165h之间)无显著影响。除了1名ESRD患者以外的其他受试者尿液内均未检出Semaglutide。血液透析也不影响Semaglutide的药代动力学特征。该项试验中的不良反应与其他GLP-1受体激动剂相似,而且未见新的安全性问题。
【主要结论】肾功能损伤者口服Semaglutide无须调整剂量。
(2)考察肝功能状态对口服Semaglutide体内药代动力学、安全性与耐受性的影响的研究(NCT02016911)
【研究机构】诺和诺德;斯洛伐克Dérer's医院。
【出处】Journal of Clinical Pharmacology. 2018, 58 (10): 1314~1323
【试验设计】单组试验。
【受试者基本信息】24名肝功能正常者、12名轻度肾功能损伤者、12名中度肾功能损伤与8中重度肾功能损伤者。
【干预方法】空腹状态口服Semaglutide制剂(先5 mg qd×5天,再10 mg×5天),所述Semaglutide制剂中含有SNAC作为吸收促进剂。
【主要结果】各肝功能状态组第10次给药后0~24h的SemaglutideAUC与第10次给药后的Cmax均无显著的组间差异,此外肝功能状态对Semaglutide的Tmax(1.0~1.5小时)或半衰期(几何均数范围142~156小时)。该项试验中未见新的安全性问题,所观察到的不良反应与其他GLP-1受体激动剂相似。
【主要结论】肝功能损伤者口服Semaglutide无须调整剂量。
(3)考察奥美拉唑对口服Semaglutide药代动力学的影响的试验
【研究机构】诺和诺德。
【出处】Expert Opinion on Drug Metabolism and Toxicology. 2018, 14(8):869~877。
【试验设计】单中心、随机化、开放标签、平行组试验。
【受试者基本信息】54名健康受试者。
【分组与干预方法】受试者随机分为两组,1组单独口服Semaglutide固体制剂;另一组同时口服Semaglutide固体制剂与奥美拉唑(40 mg qd)。所述Semaglutide固体制剂中SNAC作为吸收促进剂。
【主要结果】Semaglutide与奥美拉唑同时口服会使前者的体内暴露水平出现上升,然其上升幅度无统计学显著性,而且联合用药者的胃内pH值高于单独用药者。不良反应均呈轻度或中度,而且以消化道症状最为常见。
【主要结论】口服Semaglutide与奥美拉唑联合用药无须对前者的剂量进行调整。
2对特殊有效性参数的影响
(1)评价Semaglutide对2型糖尿病患者处于低血糖状态时胰高血糖素及其他反调节激素的影响的研究
【研究者】奥地利格拉茨医科大学与诺和诺德的研究人员。
【出处】Diabetes, Obesity and Metabolism 杂志2018年第20卷第11期。
【试验设计】随机化、双盲、安慰剂对照、交叉、单中心试验。
【受试者基本信息】38名仅采用二甲双胍治疗的2型糖尿病患者。
【干预方法】随机分组后分别采用Semaglutideqw 皮下注射或安慰剂皮下注射12周,而后交叉用药,继续治疗12周。每个治疗期结束后均进行低血糖钳夹术。
【主要结果】采用低血糖钳夹使受试者血糖从5.5 mmol/L降低至2.5 mmol/L的过程中,Semaglutide与安慰剂组组胰高血糖素的变化情况彼此相似(88.3 vs 83.1 pg/mL),而两组其他反调节激素浓度均有所上升,其中,Semaglutide组去甲肾上腺素与皮甾醇的上升值高于安慰剂对照。两组实现恒定钳夹水平所需的葡萄糖灌注速率彼此相似,提示反调节应答水平整体相似。当血糖降至2.5 mmol/L时,Semaglutide组的平均低血糖症状评分与认为发生低血糖反应的受体所占比例均低于安慰剂对照,但两组的认知功能测试结果彼此相似。Semaglutide未见新的安全性问题。
【主要结论】Semaglutide治疗不会损害2型糖尿病患者在试验型低血糖过程中的反调节应答水平。
3与其他降糖药比较的研究
(1)在采用膳食干预与增加运动(±二甲双胍)治疗效果欠佳的2型糖尿病患者中比较Semaglutideqd与利拉鲁肽有效性与安全性的研究(NCT02461589)
【研究机构】德克萨斯大学西南医学中心;内布拉斯加大学医学中心等;诺和诺德参与。
【出处】Diabetes Care. 2018 Sep;41(9):1926-1937.
【试验设计】为期26周的多中心、双盲、随机化、跨国试验。
【受试者基本信息】在膳食干预与增加运动的基础上添加或不添加二甲双胍治疗但效果欠佳(HbA1c在7.0~10.0%之间)。共入组705人。
【分组与干预方法】受试者以2:2:1的比例随机分入Semaglutide qd(0.05 mg、0.1 mg、0.2 mg与0.3mg)组、利拉鲁肽 qd(0.3 mg、0.6 mg、1.2 mg与1.8 mg)组与安慰剂组。
【主要结果】治疗26周,Semaglutide组的HbA1c呈剂量依赖性的下降,其下降值依次为-1.1%(0.05 mg)~-1.9%(0.3 mg)之间,均均显著高于体积匹配的利拉鲁肽组[-0.5%(0.3 mg)~-1.3%(1.8 mg),P<0.001],而安慰剂组汇总后下降值为-0.02%(与Semaglutide相比P<0.0001)。Semaglutide组与利拉鲁肽组最常见的不良反应是消化道不良反应,其发生率分别是32.8~54.0%与21.9~41.5%。
【主要结论】Semaglutideqd(最高剂量0.3 mg qd)的降HbA1c效果显著优于利拉鲁肽qd,但其消化道不良反应发生率也高于后者。
(2)比较Semaglutide与利拉鲁肽在肥胖症患者中有效性与安全性的研究NCT02453711
【研究机构】美国南卡罗来那医科大学;德国卡鲁古斯塔夫卡鲁斯大学医院等;诺和诺德参与并资助。
【出处】Lancet. 2018, 392(10148): 637~648
【试验设计】跨国(美国、德国、英国、以色列、加拿大等)、多中心、随机化、双盲、安慰剂对照的平行组试验。
【受试者基本信息】年龄≥18岁,未合并糖尿病的肥胖症患者(BMI≥30kg/m2)。共处组957人。
【分组与干预方法】受试者以1:1:1:1:1:1:1的比例随机分入Semaglutide0.05 mg qd、0.1 mg qd、0.2 mg qd、0.3 mg qd与0.4 mg qd组、利拉鲁肽3.0 mg qd组或匹配的安慰剂组,所有药物均每天皮下注射1次。
【主要结果】主要的有效性结果如下表所示。
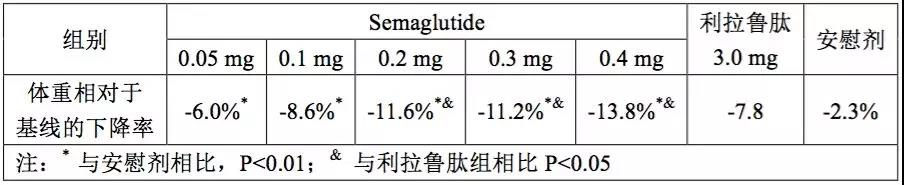
此外,Semaglutide0.1~0.4mg组体重下降≥10%的受试者所占比例(37~65%)显著高于对照组(10%)(P<0.0001)。
就安全性结果而言,Semaglutide各剂量组均具有良好的耐受性特征,未见新的安全性问题。最常见的不良反应是以恶心为主的GLP-1受体激动剂所共有的消化道症状,且具有剂量依赖性。
4药物经济学研究
(1)比较Semaglutideqw与度拉鲁肽qw在英国治疗2型糖尿病的长期成本-效益特征的研究
【研究机构】英国Lister医院;诺和诺德。
【出处】Diabetes, Obesity and Metabolism,2018年10月25日提前发表。
【主要结果】与度拉鲁肽1.5 mg qw相比,Semaglutide0.5 mg qw与1 mg qw能使英国2型糖尿病患者的预期寿命分别改善0.04与0.10质量调整的寿命年。由于Semaglutide的降糖效果优于度拉鲁肽,因此在降低糖尿病并发症的基础上获得临床效益时的成本相对较低,其中,0.5 mg qw剂量与1.0 mg qw剂量能使患者的寿命成本分别降低35英镑与106英镑,因此认为,Semaglutide0.5 mg qw与1.0 mg qw的成本效益特征优于度拉鲁肽1.5mg qw。
(2)比较Semaglutideqw与度拉鲁肽在美国实现HbA1c与体重控制效果所需成本的研究
【研究机构】诺和诺德;瑞士奥西斯健康经济与通讯有限公司。
【出处】Diabetes Therapy. 2018, 9(3): 951~961。
【主要结果】Semaglutideqw治疗后实现HbA1c控制目标的患者显著多于度拉鲁肽,而Semaglutideqw所有模拟终点指标的控制成本均低于度拉鲁肽,其中Semaglutide1.0 mg qw与度拉鲁肽1.5 mg qw用药后每患者实现三种复合终点指标的成本分别为11,916美元与15,204美元,即后者的成本比前者高28%。而为了实现相同的指标,度拉鲁肽0.75 mg qw的成本比Semaglutide0.5 mg 高68%。
【主要结论】在美国,Semaglutideqw的成本-效益特征优于度拉鲁肽qw。
5数据再评价分析
(1)评价Semaglutide治疗2型糖尿病整体安全性与有效性的系统性文献评价与Meta分析
【研究机构】我国河北医科大学。
【出处】Endocrine. 2018, 62(3):535-545
【试验与/或受试者基本信息】纳入了11项Semaglutide临床试验(N=9519)。
【主要结果】
与安慰剂及其他降糖药相比,Semaglutide能进一步改善受试者的HbA1c、自测血糖(SMPG)、空腹血糖(FPG)与体重等有效性参数,其平均差值(Semaglutide-安慰剂或其他降糖药)如下表所示。
此外,Semaglutide组实现HbA1c<7.0%的血糖控制目标的受试者所占比例也显著高于安慰剂或其他降糖药(风险比RR=2.26,95% CI:1.89~2.70,P<0.00001)。就安全性结果而言,Semaglutide组不良反应事件、严重不良反应事件与低血糖事件发生率与对照组相比的风险比(RR)如下表所示。
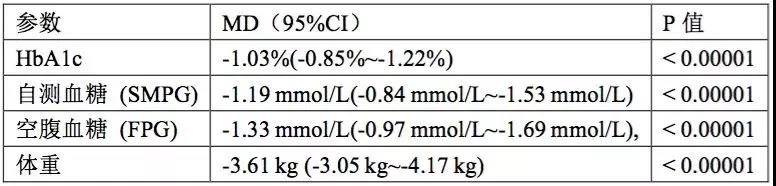
【主要结论】Semaglutide治疗2型糖尿病时具有良好的安全性与有效性特征,同时合并肥胖症或对其他降糖药依从性不佳的2型糖尿病患者可以优先考虑Semaglutide.
(2)比较Semaglutide qw与其他肠促胰素相关性降糖药在2型糖尿病患者中有效性与安全性的系统性评价与meta分析
【研究机构】东卡罗来那州大学。
【出处】Diabetes and Metabolism. 2018 Sep 20. pii: S1262-3636(18)30173-3。
【研究与/或受试者特征】共纳入5项对Semaglutide与其他肠促胰素相关性降糖药(包括其他GLP-1受体激动剂与DPP-4抑制剂)进行比较的随机对照试验。
【主要结果】
Semaglutide降低HbA1c与体重的效果均显著优于其他GLP-1受体激动剂与DPP-4抑制剂,具体结果如下表所示。
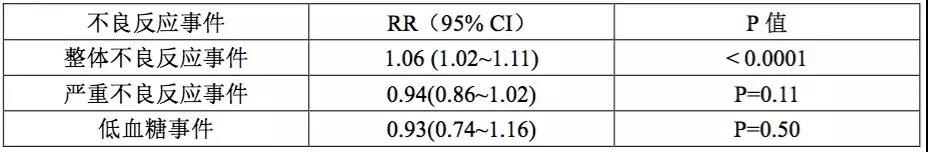
Semaglutide组实现临床显著性血糖控制效果与减重效果的受试者所占比例均显著高于其他GLP-1受体激动剂与DPP-4抑制剂。然而Semaglutide组内消化道不良反应的发生率却高于其他两组。
【主要结论】虽然临床试验中Semaglutideqw与其他肠促胰素类降糖药均能显著降低2型糖尿病患者的HbA1c,然而Semaglutide的降HbA1c与减重效果均显著优于其他肠促胰素类降糖药。与此同时,Semaglutide的消化道不良反应发生率也有所升高。
(3)比较Semaglutideqw与SGLT-2抑制剂在采用二甲双胍单药治疗血糖控制效果欠佳者中的有效性的系统性评价与Meta分析
【研究机构】加拿大Precision Xtract(市场研究机构);诺和诺德。
【出处】Current Medical Research and Opinion. 2018, 34(9):1595-1603。
【试验与/或受试者基本信息】共纳入8项时长≥20周的随机对照试验。
【主要结果】Semaglutide0.5 mg qw与1.0 mg qw改善HbA1c的效果显著优于SGLT-2抑制剂,其中,Semaglutide1.0 mg qw 降低HbA1c的效果与卡格列净300 mg与达格列净5 mg相比的MD(95% CI)分别为-0.66%(-0.82%~-0.50%)与-1.11%(-1.37%~0.85%)。此外,Semaglutide1.0 mg qw降低体重与改善空腹血糖的效果也显著优于SGLT-2抑制剂,然而两者降低收缩压的效果无显著的差异。
【主要结论】对于单独采用二甲双胍治疗效果欠佳的2型糖尿病患者而言,Semaglutideqw的血糖控制效果显著优于SGLT-2抑制剂。
(4)比较既往采用基础胰岛素治疗的2型糖尿病患者在基础胰岛素的基础上添加Semaglutide与其他GLP-1受体激动剂治疗的安全性与有效性的系统性文献评价与网络Meta分析
【研究机构】英国DRG Abacus;诺和诺和参与并资助。
【出处】Diabetes Therapy. 2018, 9(3): 1233~1251。
【试验与/或受试者基本信息】共纳入了8项评价在基础胰岛素的基础上添加Semaglutide治疗2型糖尿病的有效性与安全性的随机对照临床试验,并提取治疗后24±4周的数据进行分析。
【主要结果】Semaglutide1.0 mg qw降HbA1c与减重的效果均显著优于对照,其MD分别为-0.88%~1.39%与-1.49kg~-4.69kg。Semaglutide组发生恶心、呕吐或腹泻不良反应的概率与所有其他GLP-1受体激动剂相似。与利拉鲁肽1.8 mg相比,Semaglutide1.0 mg qw还能有效地降低爱才的收缩压。低剂量Semaglutide(0.5 mg qw)的降HbA1c效果显著优于除了利拉鲁肽1.8 mg qd以外的其他所有GLP-1受体激动剂对照,而且低剂量Semaglutide组恶心不良反应的发生率也显著低于其他GLP-1受体激动剂对照。
【主要结论】在所有的GLP-1受体激动剂中,Semaglutide1.0 mg qw用作基础胰岛素的添加疗法时降低HbA1c与减重效果最佳,而且其消化道不良反应的发生率也不高于其他GLP-1受体激动剂。
(5)在既往采用1~2种口服降糖药治疗的2型糖尿病患者中比较Semaglutide与其他GLP-1受体激动剂的有效性与安全性的系统性文献评价与网络Meta分析
【研究机构】英国DRG Abacus;诺和诺和参与并资助。
【出处】Diabetes Therapy. 2018, 9(3): 1149~1167。
【试验与/或受试者基本信息】共纳入26项在既往采用1~2种口服降糖药治疗但效果欠佳的2型糖尿病患者中评价GLP-1受体激动剂的临床试验。
【主要结果】Semaglutide1.0 mg qd降HbA1c的效果与减重效果均显著优于所有的GLP-1受体激动剂对照,而Semaglutide0.5 mg qd的上述效果则优于大部分的GLP-1受体激动剂对照。Semaglutide两个剂量组因不良反应而退出研究的受试者所占比例与其他GLP-1受体激动剂相似。
【主要结果】就作为1~2种口服降糖药的添加疗法时从基线至治疗6个的降HbA1c效果与减重效果而言,Semaglutide1.0 mg qw是所有GLP-1受体激动剂中的最优者,而且1.0 mg qw与0.5 mg qw均具有良好的耐受性特征,且不会升高因为不良反应而导致的停药率。
原创:医药地理
